介入和热消融治疗胰腺神经内分泌肿瘤肝转移
临床疗效及预后因素分析
吴梦飞1,宋华丹1,刘霄宇1,2,
颜志平1,2,刘凌晓1,2
中国实用外科杂志,2018,38(7):796-800
目的 评估介入及热消融治疗胰腺神经内分泌肿瘤肝转移的临床疗效及预后因素。方法 回顾性分析2006年5月至2017年12月于复旦大学附属中山医院接受经肝动脉化疗栓塞(TACE)及热消融治疗的45例胰腺神经内分泌肿瘤肝转移病人的临床资料。结果 45例病人中无治疗相关死亡病例。中位总生存期(OS)为60.1(95%CI 14.181~106.086)个月,中位无进展生存时间(PFS)为18.3(95%CI 13.078~23.589)个月。1、3、5和7年总存活率分别为83.8%、65.3%、52.9%和37.0%。TACE的总有效率为71.5%,热消融治疗的总有效率为96.2%。COX多因素分析提示原发病灶切除是总生存期的独立预后因素(HR=0.358,95%CI 0.136~0.9412,P=0.037),原发病灶切除病人5年存活率为70.9%,而未行原发病灶切除者为32.5%。结论 TACE和热消融治疗对胰腺神经内分泌肿瘤肝转移病人安全有效。
作者单位:1复旦大学附属中山医院介入科,上海200032;2上海市影像医学研究所,上海200032
通信作者:刘凌晓,E-mail:liu.lingxiao@zs-hospital.sh.cn.
胰腺神经内分泌肿瘤(pNENs)在胰腺肿瘤中发病率为1%~2%[1-2],肝脏是pNENs最常见的转移部位,占所有转移的50%[3]。pNENs治疗方法根据肿瘤TNM分期以及WHO 2010分级进行选择[4-5]。目前,肿瘤外科切除是治疗pNENs的根治性方法,但伴有肝转移的病人仅20%有机会接受外科手术[1]。由于pNENs是一种富血供肿瘤,肝转移瘤主要从肝动脉获得营养,因而经肝动脉化疗栓塞(TACE)成为其常用治疗方法。同时,热消融尤其是射频消融技术对直径<3 cm原发性肝癌的治疗效果已与外科手术相近[6]。本研究回顾性分析复旦大学附属中山医院介入科采用TACE及热消融治疗pNENs肝转移病人的有效性及安全性,并分析相关影响因素。现报告如下。
1资料与方法
1.1 一般资料 回顾性分析2006年5月至2017年12月复旦大学附属中山医院收治的45例pNENs肝转移病人的临床资料(表1)。其中男性25例,女性20例。年龄32~86(58.4±10.9)岁。经医院伦理委员会批准,所有病人术前均签署知情同意书。诊断标准:经皮肝穿刺活检标本或手术标本由组织病理学和免疫组化检查结果进行确诊。
1.2 治疗方法 所有病人入院后行术前检查,排除手术禁忌。病人术前2周内行腹部增强CT或MRI检查,以观察病灶的位置、大小、血供以及毗邻组织等情况。排除标准:(1)门静脉主干阻塞。(2)胆红素> 51.3 μmo/L,天冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)>正常值上限的5倍。(3)严重的心、肾功能不全。(4)造影剂过敏。(5)凝血功能障碍(国际正常化比值>1.6,血小板计数<40×109/L)。
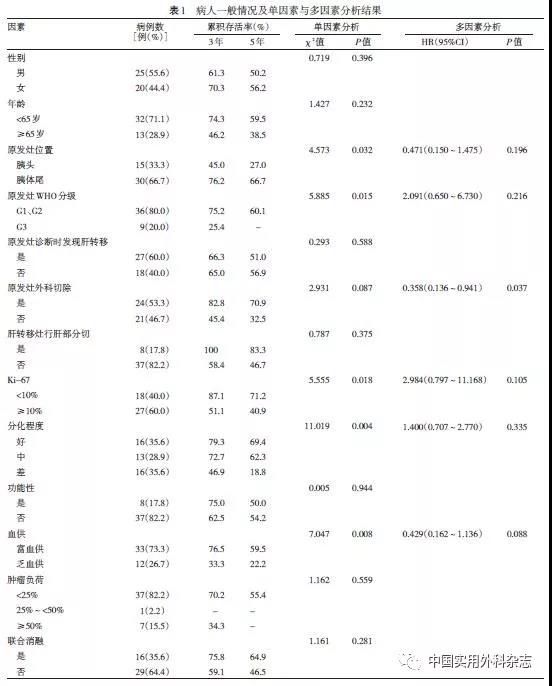
1.2.1 TACE 病人仰卧位,取右侧股动脉穿刺点,用2%利多卡因皮下注射局麻,使用Seldinger技术穿刺股动脉,引入5F鞘,在数字减影血管造影(DSA)引导下,以5F 肝动脉造影导管,通过肝总动脉和肠系膜上动脉进行动脉血管造影(图1a)。依据术中肿瘤染色情况,超选择至肿瘤供血血管,将合适剂量的表阿霉素或表柔比星(30~50 mg)、奥沙利铂(100~150 mg)和超液体碘化油(5~10 mL)混合液在DSA透视下缓缓注射到肿瘤供血血管中。然后将微导管退至合适位置,造影观察肿瘤染色,注入5~10 mL超液化碘化油,以阻塞含有化疗药物的血管,一方面使化疗药局限在病灶,另一方面栓塞血管(图1b)。必要时加用明胶海绵颗粒加强栓塞。重复该过程直到肿瘤染色消失。手术结束,穿刺处加压包扎,制动6 h,12~24 h后拆除绷带下床活动。对于肝左右叶多发转移灶并且肿瘤负荷>70%的病人,考虑到双侧肝叶转移灶同时化疗栓塞可能会导致术后肝功能的恶化,故单次手术只处理一侧肝叶转移灶。
1.2.2 经皮肝肿瘤热消融术 术前准备同TACE,根据术前影像学资料及术中超声检查对肝部病灶进行定位,制定穿刺路径,使用2%利多卡因皮下注射局麻,17G射频消融电极针或14G水冷微波消融针沿转移瘤最大径进入病灶(射频消融电极针尖达到病灶中心位置,水冷微波消融针尖通常超过病灶远端约0.5 cm),选用合适的功率消融病灶(60~110 W),直至超声下观察到高回声区覆盖整个瘤体,并超出瘤体0.5~1.0 cm,以50W功率边退针边消融针道,穿刺口敷贴。返回病房后严密监测生命体征24 h。
射频消融和微波消融的选择取决于病灶是否邻近大血管、肝包膜以及胆囊、肠管等空腔器官。
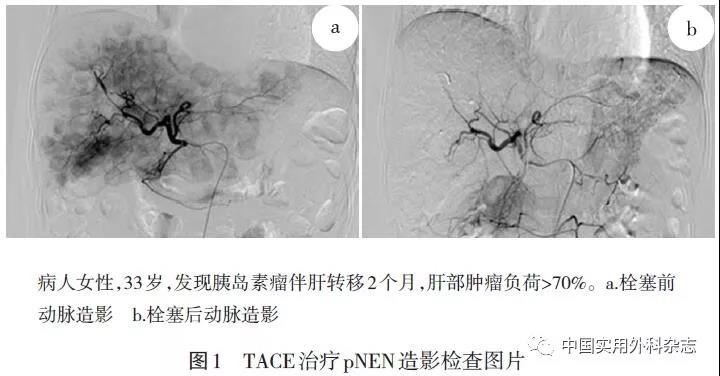
1.2.3 TACE同步经皮肝肿瘤热消融术 术前准备同TACE,通过肝总动脉和肠系膜上动脉进行动脉血管造影。依据术中肿瘤染色情况,超选择至肿瘤供血血管。结合术前影像及术中DSA、超声检查结果,制定穿刺路径,局麻,消融针进入病灶消融,消融结束后再次造影,明确病灶坏死情况以及是否有出血或动脉门静脉瘘的发生,如发现残留血管染色,根据残留血管染色位置选择消融治疗或TACE治疗(图2)。
治疗后,所有出现栓塞后综合征病人均须对症处理。术后监测肝功能直至恢复术前水平。转移瘤直径>5 cm病人术前30 min及术后2 d使用抗生素用于预防感染。接受分次治疗的病人2次治疗须间隔1~3个月。所有病人在行TACE前和治疗期间均未使用其他抗肿瘤药物。pNENs肝转移治疗尚无统一指南,治疗原则参照2013年《中国胃肠胰神经内分泌肿瘤专家共识》[7] 。
1.3 疗效评估及随访 术后2个月内行腹部增强CT或MRI评估病灶,显示病灶强化定义为病灶有活性,第1次随访提示有活性灶则需TACE或经皮消融治疗,若提示完全坏死,则继续随访,3~6个月复查腹部增强CT或MRI。疗效评估采用实体肿瘤疗效评估修订版(m-RECIST)进行[8]。通过比较治疗前后活性病灶的大小来评估治疗效果。根据m-RECIST标准,将疗效评估分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。总有效率定义为(CR+PR)/总治疗次数;术后严重并发症定义为30 d内出现导致住院时间延长、致残或致死的手术相关的并发症。
1.4 统计学处理 采用SPSS24.0软件分析数据。连续变量表示为均数±标准差,总生存期(OS)和无进展生存期(PFS)使用 Kaplan-Meier分析并绘制曲线;使用Log-rank检验行单因素分析(性别、年龄、原发灶位置、原发部位切除、转移灶肝部分切、原发灶WHO分级、Ki-67表达、肿瘤分化程度、肿瘤血供情况、肿瘤负荷),Cox回归模型行多因素分析。P<0.05为差异有统计学意义。
2结果
2.1 一般情况 45例病人中,27例确诊pNENs同时发现肝转移灶,17例为非同步肝转移,另1例在发现肝内病灶7个月后发现胰腺原发灶。非同步肝转移病人的肝转移出现时间为1.0~168.3(32.5±44.2)个月。原发病灶位于胰头部的15例中,7例(46.7%)接受胰腺肿瘤切除术。原发病灶位于胰体尾部的30例中,18例(60%)接受胰腺肿瘤切除。21例因胰腺病灶无法行手术切除,TACE被选为一线治疗,其他24例肝转移灶TACE术前接受胰腺肿瘤切除术。有8例因肝部转移灶曾行部分肝切除术;16例联合经皮肝肿瘤消融治疗,其中8例行TACE同步消融治疗。
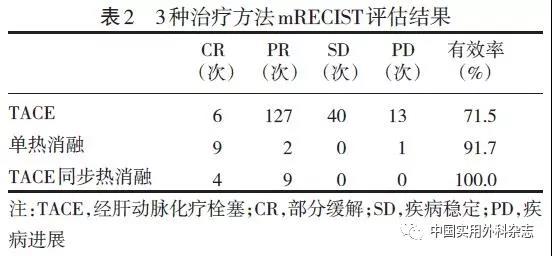
2.2 疗效及并发症 45例病人共行186次TACE、15次射频消融、10次微波消融,其中14次为TACE同步热消融治疗,共计211次治疗,平均治疗次数为4.7次。参照mRECIST标准,CR、PR、SD和PD分别为19、138、40和14次,其中热消融治疗评估为CR、PR、SD和PD分别为13、11、0和1次。 TACE的总有效率为71.5%,热消融治疗的总有效率为96.2%(单消融 91.7%、同步消融 100%)。见表2。
所有病人接受治疗期间没有出现严重的术中并发症。大多数病人在治疗后1个月内出现轻度肝功能损伤,通过保肝及支持治疗,均较快恢复。3例病人出现肝脓肿,均在脓肿引流后痊愈;1例病人术后出现胆囊炎,保守治疗后好转。1例G3(Ki-67为35%)病人在2次TACE后评估为进展,转行化疗。4例病人在治疗过程中发现了淋巴结转移,加行放疗。
2.3 后续治疗及生存分析 截至2018-05-01,中位随访时间为79.5个月,平均为(74.1±38.1)个月。生存曲线参见图3,中位OS为60.1(95%CI 14.181~106.086)个月,中位PFS为18.3(95%CI 13.078~23.589)个月。共有21例病人死亡。所有的死亡均与肿瘤有关。1、3、5和7年的存活率分别为83.8%、65.3%、52.9%和37.0%。
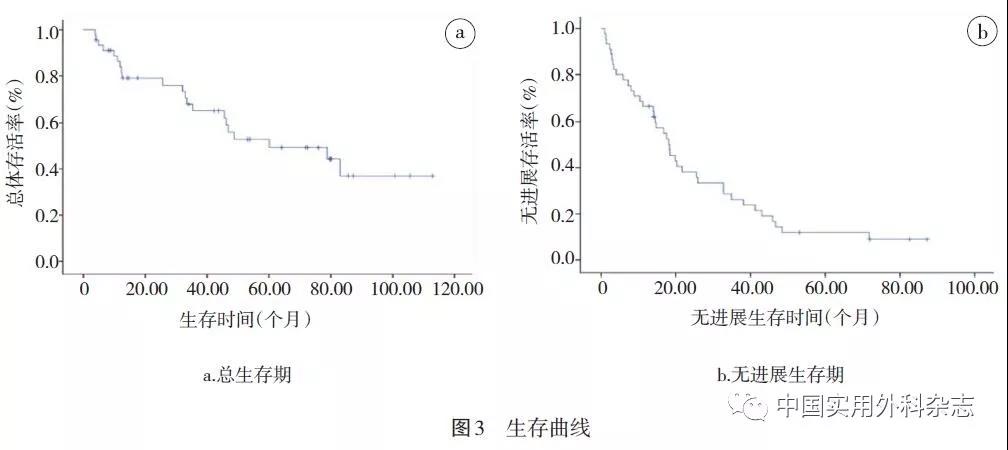
2.4 影响因素分析 Log-rank检验单因素分析显示,Ki-67低表达(<10%)、肿瘤分化好和WHO分级低(G1/G2)、原发病灶位于胰体尾、肝转移灶富血供与OS正相关。另外,Log-rank检验单因素分析不能校正混杂因素,筛除标准宜留有余地,故将单因素分析P<0.1的影响因素纳入COX回归模型进行多因素分析。多因素分析显示,原发病灶切除是pNENs肝转移病人接受TACE和热消融治疗OS的独立预测因素(HR=0.358,95%CI 0.136~0.941,P=0.037)(表1)。原发灶切除病人中位OS为83.0(95%CI 73.894~92.039)个月,优于未行原发灶切除手术病人的35.3(95%CI 19.625~51.042)个月。
3讨论
目前,关于pNENs肝转移局部微创治疗的研究并不多。文献报道,不接受肝部分切除治疗的pNENs肝转移病人5年存活率约为35%[9]。目前,对于pNENs肝转移病人,外科手术是最好的减瘤手段。然而,肝转移灶减瘤切除术创伤较大,术后复发率也很高,有文献报道达76%[7]。TACE是肝富血供肿瘤最常用的局部治疗方法,近十几年来,经皮肝肿瘤热消融治疗也日渐受到关注。本研究旨在探究TACE以及热消融治疗pNENs肝转移的有效性以及安全性。
研究发现,WHO分期是pNENs肝转移总生存时间重要的预后因素之一。而目前多数研究将重点放在了G1或G2期病人,仅有少数研究观察G3期病人的病理学变化以及化疗效果[10-11]。本研究比较了G1、G2 期与G3期病人的生存期。G1、G2期病人的中位生存期为78.8个月,而G3病人的中位生存期为25.6个月。G1、G2期病人中位生存期优于其他文献报道数据[12-13],这可能与联合热消融治疗以及TACE的超选择技术有关。
单因素分析结果提示,Ki-67表达<10%、G1期、G2期、分化良好的病人得到了更好的生存获益,提示这些因素可能是pNENs肝转移病人生存期的预测指标。与既往研究相符[14]。而且,肝转移灶富血供病人生存期优于乏血供病人,由于TACE治疗的主要作用途径为栓塞肿瘤供血动脉,切断肿瘤供血供氧,故TACE理论上应该对富血供pNENs肝转移的治疗更优。
已有研究证实胰腺原发病灶切除可以使伴有肝转移的pNENs病人生存获益[14]。本研究中原发病灶位于胰头病人的生存期较短,分析可能是由于胰头肿瘤病人中原发病灶接受手术切除的比例低于胰体尾肿瘤病人。
本研究中热消融总有效率为96.2%,而TACE治疗的总有效率为71.5%,该结果提示联合消融治疗可以提高有效率。TACE的主要作用途径为栓塞肿瘤的供血动脉,对于乏血供病灶,TACE的作用受限,热消融对于该类病人有其独特的优势。2010年,笔者中心开展了TACE同步热消融治疗,同步治疗有以下优势[15]:(1)消融术后即刻造影可以减少消融术中、术后发生出血以及动脉门静脉瘘的风险。(2)术前腹部增强CT或MRI、术中超声、术中DSA检查可提高病灶检出率。(3)消融与TACE共同作用,提高有效率。(4)热消融后即刻TACE可使受到亚致死热量损伤的肿瘤组织坏死更彻底,增加热消融的治疗效果。
本研究为回顾性研究,不可避免存在一定偏倚,而且没有将胰腺G3高增殖活性肿瘤和胰腺神经内分泌癌分类讨论,这一方面也值得进一步分析。
综上所述,TACE和热消融治疗是胰腺神经内分泌肝转移的有效治疗方法。另外,对于符合适应证的病人,建议行原发病灶切除,这对病人的总生存期有益。
